Gliomi ad alto grado
I gliomi ad alto grado sono tumori primitivi cerebrali ad alto grado di malignità e aggressività biologica. Questo aspetto riflette un comportamento tendenzialmente aggressivo del tumore ed una crescita rapida, anche se con alcune eccezioni. Il picco di incidenza cade tra i 40 e i 60 anni di età senza prevalenza di genere; rappresentano l’85% dei tumori gliali nel soggetto adulto e raggiungono una frequenza di oltre il 90% dei casi di tumore primitivo cerebrale dopo i 70 anni di età.
Patologia
I gliomi ad alto grado comprendono l’astrocitoma anaplastico, il glioblastoma, con le loro varianti, il gliosarcoma, glioblastoma giganto-cellulare, e la gliomatosi cerebrale. In particolare il tumore ad alto grado più diffuso per frequenza è il glioblastoma. La gliomatosi cerebrale è una condizione in cui vi è una disseminazione di cellule tumorali nelle vie liquorali (ventricoli cerebrali, spazi subaracnoidei) con secondaria diffusione della malattia in tutto il sistema nervoso centrale (nevrasse), in particolare sulla superficie degli emisferi cerebrali, sui nervi cranici e sulla superficie del cervelletto. Rappresenta uno stadio avanzato di malattia e, una volta diagnosticata, è indirizzata alle terapie adiuvanti. Questa condizione ha purtroppo un’elevata mortalità; quando indicato, viene trattata con terapia sistemica (chemioterapia), RT panencefalica (su tutto l’encefalo) e, nel caso di sviluppo di idrocefalo, con intervento di derivazione ventricolo-peritoneale.
Altre forme diffuse sono i gliomi multifocali; in questi casi il tumore presenta diversi noduli localizzati su entrambi gli emisferi, anche in questo caso la terapia di elezione è la chemioterapia con temozolomide e la radioterapia.
Gliomi ad alto grado
Sono anch’essi tumori relativamente rari, con una istologia maligna, caratterizzati in particolare dalla presenza di atipie nucleari, aumentato numero di mitosi, presenza di neoangiogenesi e necrosi. La presenza di neoangiogenesi consente di distinguere l’astrocitoma anaplastico (grado III) dagli astrocitomi di basso grado. La presenza invece di necrosi è caratteristica dei tumori di grado IV, glioblastoma. Il gliosarcoma ha prevalenti componenti mesenchimali o connettivali. Indici di prognosi peggiore includono l’età più avanzata, una scarsa condizione fisica generale, un danno neurologico significativo. La necrosi dei glioblastomi ha caratteristiche morfologiche tipiche e viene definita per la sua conformazione, necrosi a palizzata (palisading necrosis). Sono curabili con approcci terapeutici multimodali, che includono la chirurgia, la radioterapia e la chemioterapia.
Gli aspetti caratteristici da ricercare anche nei gliomi ad alto grado di malignità sono:
- presenza/assenza della codelezione 1p19q
- indice mitotico (MIB o Ki67)
- presenza/assenza di mutazione del gene IDH1, 2 e ATRX
- mutazione inattivante della proteina p53
- definizione della componente astrocitaria e oligodendrogliale
Questi aspetti hanno un valore terapeutico e prognostico molto importante. In particolare lo stato di metilazione del gene MGMT è predittivo della sensibilità della malattia al trattamento tradizionale con Temozolomide, pertanto fondamentale per la scelta terapeutica. Il recettore per l’EGF, epidermal growth factor, EGFR, è un indice prognostico importante nei gliomi ad alto grado. La iper-espressione nella sua variante III, vIIIEGFR, è indice di aggressività biologica del tumore. Questo aspetto va considerato nella pianificazione terapeutica.
Clinica
I pazienti con gliomi ad alto grado possono presentare crisi epilettiche (generalizzate o parziali), deficit neurologici focali, cefalea, modificazioni della personalità e segni di ipertensione intracranica (cefalea, vomito e disturbi visivi).
Diagnosi
La diagnosi viene effettuata con tecniche di imaging tradizionale, TC e RM, e tecniche di neuroimaging avanzato ovvero RM ad alto campo magnetico (3 Tesla). Anche in questo caso, la spettroscopia consente di definire la composizione chimica del tessuto malato, aumentando il potere diagnostico dell’imaging preliminare.
- La RM rivela generalmente la presenza di una lesione con aumento di segnale di contrasto (enhancement), anche se vi sono casi in cui tale enhancement non è evidente. Spesso la presa di contrasto è marginale, detta anche presa di contrasto ad anello e rappresenta l’alterazione della membrana tra cervello e sangue, detta barriera amato-encefalica. La presa di contrasto nelle patologie gliali, fatta eccezione per gli astrocitomi pilocitici, è quasi sempre espressione di patologia ad alto grado.
Trattamento
L’approccio terapeutico ai gliomi ad alto grado è multimodale e include chirurgia, radioterapia e chemioterapia. La chirurgia, laddove percorribile, è il passo fondamentale e va eseguita in centri ad alta specializzazione come il San Raffaele. Alla chirurgia va necessariamente affiancata la radioterapia e la chemioterapia come terapia adiuvante (Temodal).
E’ ormai riconosciuto a livello mondiale lo schema Stupp che prevede una prima fase di chemioterapia concomitante alla radioterapia ed una seconda fase di chemioterapia adiuvante di mantenimento. In seconda linea si utilizza un farmaco biologico che inibisce la formazione di nuovi vasi (neoangiogenesi), il farmaco anti-angiogenetico Bevacizumab, per ridurre il nutrimento al tumore,
Anche per i gliomi ad alto grado lo stato di metilazione del gene MGMT, la mutazione del gene IDH-1, IDH-2, ATRX, la perdita di eterozigoti 1p19q e la mutazione di un gene che sopprime il tumore, il p53. Altri indicatori fondamentali sono l’indice mitotico (ki67), indicatori ormai validati della prognosi della malattia.
In generale, l’esito terapeutico è migliore dopo resezione chirurgica “completa”, ma non è chiaro se tale miglior risultato è da associare all’intervento in sé o allo scenario clinico complessivo che ha permesso tale resezione.
Chirurgia
Il trattamento standard prevede come primo passo la massima asportazione possibile, cercando di limitare la morbidità e di non indurre un deficit funzionale al paziente “maximal safe resection”. E’ necessario che al chirurgia venga effettuata in un centro ad alta specializzazione come il San Raffaele. Questo garantisce al Paziente il massimo della tecnologia disponibile e l’esperienza di un’equipe con training specifico per affrontare la malattia. Si è visto che nei centri ad alto flusso questo tipo di chirurgia è gravata da minori complicanze. Le nuove frontiere in questo tipo di chirurgia sono la neuronavigazione, l’ecografia intra-operatoria, la fluorescenza intra-operatoria, la microscopia intra-operatoria, la chirurgia a paziente sveglio, il monitoraggio neurofisiologico intra-operatorio.
Radioterapia e chemioterapia
Sono uno standard nel trattamento (protocollo Stupp) in quanto hanno dimostrato di prolungare in modo significativo la durata della sopravvivenza. Lo schema Stupp prevede due fasi. La prima di chemioterapia concomitante alla radioterapia. La seconda di chemioterapia adiuvante di mantenimento (5 gg di trattamento ogni 28 giorni per 6 cicli di trattamento). In seconda linea si utilizza un farmaco biologico che inibisce la formazione di nuovi vasi (neoangiogenesi), farmaco anti-angiogenetico o Bevacizumab. Così si riduce il nutrimento al tumore. La radioterapia è erogata in 30 frazioni, 30 giorni di trattamento (5 giorni a settimana per 6 settimane). Le applicazioni durano pochi minuti e non sono dolorose. Può essere utile accompagnare il periodo di radioterapia con la somministrazione di cortisone per controllare l’effetto irritativo della radiazione sul tessuto cerebrale.
Approccio multimodale
La strategia terapeutica deve sempre prevedere un intervento collegiale e solidale (Disease Unit) tra neurochirurgo, radioterapista, patologo, neuroncologo e neuroradiologo. L’approccio terapeutico va necessariamente individualizzato, ovvero ritagliato sul singolo paziente, seguendone esigenze cliniche ed oncologiche. In particolare per i pazienti anziani (>75 anni) sono riservati protocolli dedicati con cicli di radioterapia ipofrazionati (riduzione della dose erogata e delle frazioni di trattamento).
Lesioni non operabili
In alcuni casi il tumore può non essere aggredibile chirurgicamente per sede o estensione della malattia. In questi casi è fondamentale avere una diagnosi istologica, per lo più attraverso una biopsia stereotassica, per poterne valutare il profilo molecolare e il grado di aggressività biologica. Una volta ottenuta la diagnosi istologica, il caso viene discusso in Disease Unit (riunione multidisciplinare neuroncologica) e valutata la strategia terapeutica migliore, che di solito coinvolge radioterapia, chemioterapia o eventuali nuovi approcci terapeutici sperimentali. Al San Raffaele il Dr. Gagliardi collabora in diversi progetti di sperimentazione clinica di nuovi farmaci per il glioblastoma.
Prognosi
La mediana di sopravvivenza mostra un intervallo variabile che va da 24 mesi a più di 36 mesi. L’ampiezza di questo campo di variazione riflette i criteri di selezione dei pazienti. In particolare la storia naturale dei gradi III è di 2-3 anni, mentre nel glioblastoma è di 18 mesi. In caso di recidiva (dopo la radioterapia) il ricorso alla chemioterapia non pone dubbi: sia i regimi basati sulla nitrosouree, sia la Temozolomide hanno mostrato efficacia.
Nelle recidive va sempre valutata anche l’opzione chirurgica. La chirurgica va attentamente considerata in base alla sede, alla diffusione di malattia e al tempo intercorso dalla chirurgia precedente.
La risposta alla Temozolomide è del 35% per pazienti che non hanno ricevuto chemioterapia in precedenza e del 20% per pazienti che sono al successivo regime di chemioterapia (in particolare dopo nitrosouree).
In seconda linea si utilizza un farmaco biologico che inibisce la formazione di nuovi vasi (neoangiogenesi), farmaco anti-angiogenetico (Bevacizumab), con infusioni ogni 2 settimane per 4 cicli totali. Recentemente è stato introdotto anche un anticorpo monoclonale. Questo inibisce gli enzimi che favoriscono la proliferazione delle cellule tumorali (Regorafenib). In ogni caso si tratta di malattie ad elevata aggressività clinica e biologica. Per questo è necessaria la tempestività della diagnosi e della terapia.
Patologia gliale
Recenti lavori hanno evidenziato come fattori critici per la prognosi, l’età, la dimensione del tumore, il grado di resezione, la componente astrocitaria nell’istologia, l’indice mitotico, la presenza di marcatori molecolari specifici sono critici per la prognosi. E’ fondamentale che i pazienti con gliomi ad alto grado vengano trattati in centri specializzati. Qui ci sono tutte le tecnologie diagnostiche e terapeutiche disponibili per ottenere il trattamento migliore.
Al San Raffale queste patologie sono curate con un approccio multidisciplinare all’avanguardia. Il Dr. Filippo Gagliardi si occupa della chirurgia della patologia gliale ed è membro responsabile della Disease Unit di Neuroncologia dell’ospedale, nonché referente per la Neurochirurgia.
Attualmente la ricerca sta facendo enormi passi avanti nella comprensione dei meccanismi biologici che sottendono l’aggressività clinica di queste patologie. Il Dr. Gagliardi partecipa attivamente alla ricerca pre-clinica in questo ambito e a sperimentazione cliniche multicentriche di nuovi farmaci e protocolli terapeutici.
Di seguito un immagine intra-operatoria di una ecografia. Ecco il prima e il dopo la resezione di un tumore gliale ad alto grado di malignità.
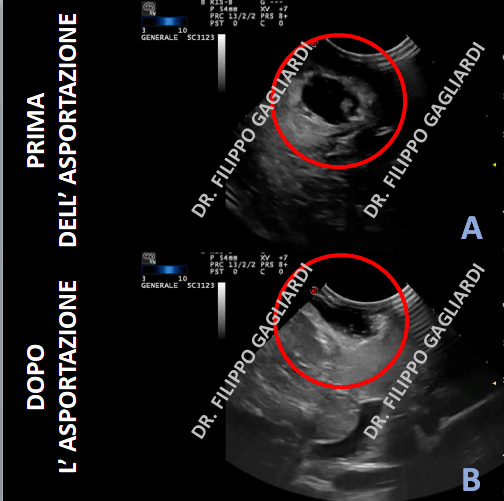
resezione gliomi ad alto grado